Использование рибофлавина и цитрата магния в акушерстве и гинекологии
12.03.2019
Громова О.А.1, Торшин И.Ю.1, Тетруашвили Н.К.2, Рейер И.А.1
Использование рибофлавина и цитрата магния
в акушерстве и гинекологии
1Федеральный исследовательский центр "Информатика и управление" Российской Академии Наук, г. Москва, Россия
2ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова МЗ РФ, г. Москва, Россия

Низкая обеспеченность клеток витамином В2 и магнием приводит к снижению активности деацетилазы сиртуин-1 и повышению активности провоспалительного фактора NF-kB, снижению уровней глутатиона, повышению уровней гомоцистеина, тромбообразованию, активности митохондрий, развитию мигрени, судорогам и невынашиванию. Рассмотрена роль рибофлавина в регуляции фолатного цикла при генотипе MTHFR 677TT для профилактики фолатрезистентных пороков развития плода, преимущества водного раствора рибофлавина и цитрата магния. Приведены данные о диоксиде титана, повышающего уровень провоспалительных цитокинов IL-1b, IL-4, IL-5, IL-6, G-CSF, CCL-2, CCL-3, CCL-4.
Ключевые слова: фолатный цикл, рибофлавин, цитрат магния, Диаспорал-300, MTHFR 677TT, персонализированная медицина
Gromova OA.1, Torshin I.Yu.1, Tetruashvili N.K.2, Reier I.A.1
1FIC IU RAS, Moscow, 2FGBU NMIC of the AHP VI Kulakova
ВведениеСовременные научные данные о микронутриентах позволяют оценить эффективность того или иного микронутриента, начиная от молекулярно-клеточного уровня и заканчивая клиническим портретом индивидуального пациента. Например, женщина, страдающая невынашиванием и предъявляющая жалобы одновременно на приступы мигрени, астению, симптомы коньюктивита и себорею, должна быть обследована на предмет недостаточности рибофлавина. Действительно, низкая обеспеченность клеток рибофлавином (витамином В2) приводит к снижению активности митохондрий (что соответствует астении), снижению активности деацетилазы сиртуин-1 и повышению активности провоспалительного фактора NF-kB (что способствует истончению роговицы глаза и, также, развитию мигрени, формированию хронического асептического воспаления и ускоренного старения [1]). Дефицит рибофлавина способствует повышению оксидативного стресса, снижению уровней глутатиона и повышению уровней гомоцистеина [2], что усиливает тромбообразование, повышает риск развития мигренозной головной боли и невынашивания.
Обычно, упоминаемые выше патологические состояния (гипергомоцистеинемия, усиленное тромбообразование, невынашивание и др.) ассоциируют исключительно с недостаточностью фолатов (и, иногда витаминов В6 и В12) и, практически никогда, с недостаточностью витамина В2. Игнорирование участия производных витамина В2 в фолатном цикле опасно упущением возможности своевременной профилактики невынашивания и фолат-резистентных врожденных пороков развития (ВПР). Если недостаточная обеспеченность рибофлавином сочетается с недостаточностью магния, то это усугубляет и дисфункцию митохондрий, и гипергомоцистеинемию, и воспаление и тромбообразование [3]. В настоящей статье последовательно рассмотрены наиболее важные аспекты применения рибофлавина и магния в акушерстве и гинекологии.
Рибофлавин как один из важнейших синергистов фолатовРибофлавин (витамин B2) - водорастворимый витамин, биологические роли которого определены вхождением рибофлавина в коферменты флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Всего известно более 180 ФАД- и ФМН-зависимых белков протеома человека. ФАД/ФМН-зависимые ферменты принимают участие в энергетическом метаболизме (окисление углеводов, жирных кислот, пирувата, разветвленных аминокислот, поддержка «цепи переноса электронов» в митохондриях и др.), инактивируют и окисляют токсичные альдегиды, участвуют в биосинтезе глутатиона и желчных кислот [4].
ФАД является кофактором глутатионредуктазы, поэтому недостаточность витамина В2 снижает уровни глутатиона и антиоксидантную защиту. Заметим, что мета-анализ 18 исследований указал на измерение коэффициента активности глутатионредуктазы эритроцитов как эффективный биомаркёр недостаточности рибофлавина (P<0.00001) [5]. Снижение активности ФАД/ФМН-зависимых ферментов в различных тканях и приводит к внешним проявлениям недостаточности рибофлавина: хейлозу, стоматиту, отёку и покраснению языка, себорейному дерматиту носогубной складки, крыльев носа, слухового прохода, ушах, век, а также к покраснению глаз, светобоязни, конъюнктивиту, кератиту, анемии, жгучим болях и судорогам икроножных мышц [6].
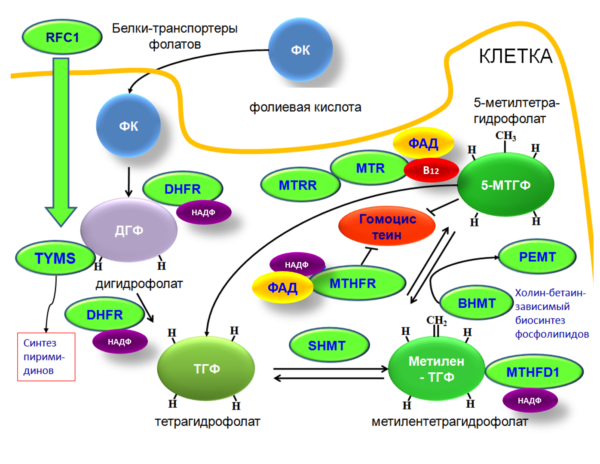
Важно отметить участие флавиновых ферментов в биосинтезе активных форм фолатов. Анализ метаболизма фолатов показывает, что такие важнейшие для фолатного метаболизма ферменты, как метилентетрагидрофолатредуктаза (ген MTHFR) и метионин синтетаза (ген MTR) нуждаются во флавиновых кофакторах. Участие соответствующих ферментов в процессах фолатного метаболизма отражено в диаграмме на Рис. 1.
Рис. 1. Ферменты и белки метаболизма фолатов и смежных метаболических путей. Приведены международные обозначения генов: RFC1 - транспортер восстановленных фолатов; DHFR – дигидрофолат редуктаза; SHMT – серин гидроксиметил трансфераза; MTHFD1 - метилентетрагидрофолат дегидрогеназа; MTHFR– метилентетрагидрофолат редуктаза, MTR - метионин синтетаза; MTRR - метионин синтетаза редуктаза; PEMT, фосфатидилэтаноламин N-метилтрансфераза; BHMT, бетаин-гомоцистеин-метилтрансфераза. Указаны кофакторы соответствующих ферментов: ФАД, флавинаденин динуклеотид (производное витамина В2); В12, витамин В12 (метилкобаламин); НАДФ – никотинамидаденин динуклеотид фосфат.
Важно подчеркнуть, что активность указанных на Рис. 1. ферментов влияет не только на уровни активных фолатов, но и на уровни гомоцистеина. Повышенные концентрации поддерживают воспаление, способствуют повреждению стенок сосудов; на поврежденную поверхность осаждаются холестерин и кальций, образуя атеросклеротическую бляшку. Повышенный уровень гомоцистеина также усиливает тромбообразование. Поэтому, гомоцистеин иногда образно называют «сосудистым ядом», т.к. повышенный уровень гомоцистеина – независимый фактор сердечнососудистого риска. Повышенные уровни гомоцистеина во время беременности могут быть причиной таких осложнений, как спонтанные аборты, преэклампсия и эклампсия, венозная тромбоэмболия. Мета-анализ 24 ретроспективных исследований (n=3289) и трех проспективных исследований (n=476) подтвердил, что более высокие уровни гомоцистеина в крови ассоциированы с более высоким риском венозного тромбоза. Увеличение уровня гомоцистеина на каждые 5 микромоль/л было связано на 27% (95% CI 1-59) более высоким риском развития венозного тромбоза в проспективных исследованиях и 60%-ым повышением риска (95% CI 10-134) в ретроспективных исследованиях [7].
Из поступающего в организм рибофлавина синтезируется ФАД - кофактор фермента MTHFR (Рис. 2), поэтому улучшение обеспеченности рибофлавином способствует снижению уровней гомоцистеина [2]. При недостатке рибофлавина происходит ингибирование этого фермента, что имеет эффект, биохимически схожий с эффектом полиморфизма 677 С/Т в гене MTHFR, соответствующего т.н. термолабильной форме фермента. Полиморфизм 677 С/Т (A223V) гена MTHFR широко распространен в различных популяциях, частота встречаемости варианта 677Т у российских женщин составляет 20-30%. Вариант 677Т в гене MTHFR приводит к синтезу мутантной формы фермента, в которой аланин-223 заменен на валин. Эта форма фермента отличается более низкой стабильностью и более быстро деградирует, способствуя понижению уровня фолатов крови и повышению уровня гомоцистеина и ослаблению интенсивности биотрансформаций в цикле фолатов [8].
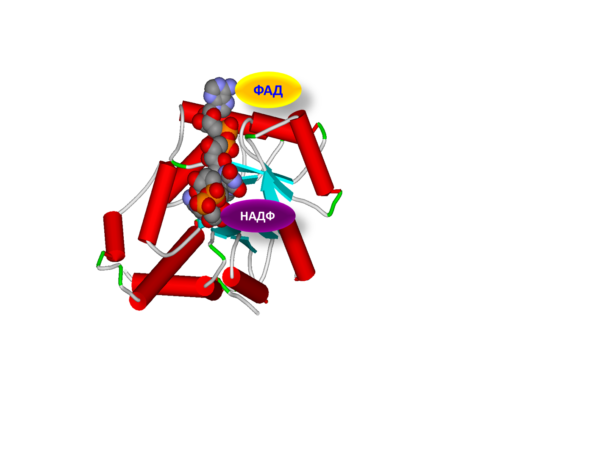
Рис. 2. Пространственная структура метилентетрагидрофолат редуктазы. Показаны структура фермента (трубчатая модель), коферменты ФАД (флавинадениндинуклеотид) и НАД (никотинамидинуклеотид) в активном центре фермента.
Выраженное снижение уровней гомоцистеина в ответ на дотации рибофлавина было установлено у здоровых добровольцев с генотипом 677ТТ гена MTHFR: уровни гомоцистеина снижались на 20…40% [9]. Как видно из Рис., ФАД связывается в центре молекулы фермента и, тем самым, стабилизирует структуру молекулы фермента MTHFR, снижая негативные эффекты «термолабильной» формы фермента. Это имеет важнейшее значение для поддержания персонализированного поддержания физиологической беременности, т.к. с генотипом 677ТТ MTHFR ассоциированы многочисленные патологические состояния, отягощающие течение беременности.
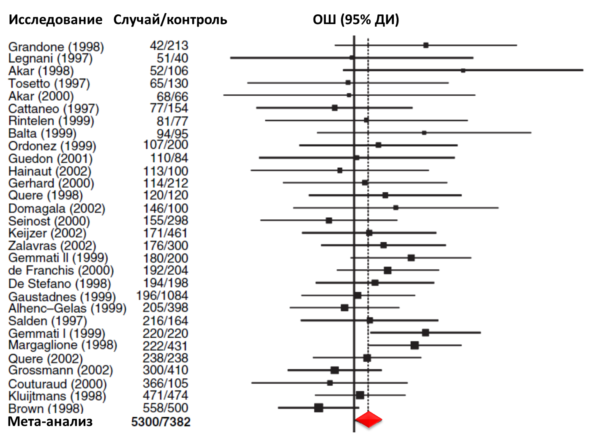
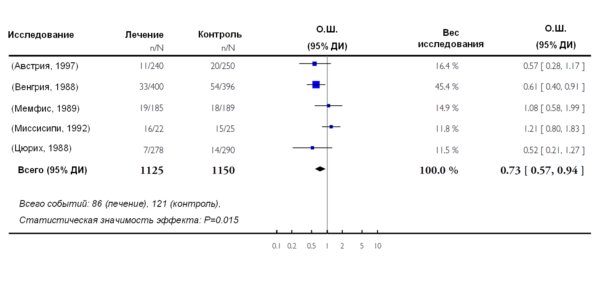
Например, метаанализ 53 исследований (n=8364) генотипа MTHFR 677TT (который соответствует термолабильной форме фермента MTHFR и, следовательно, повышенному уровню гомоцистеина) подтвердил, что генотип 677TT, по сравнению с генотипом 677CC, был ассоциирован с 20%-ым повышением риска венозного тромбоза (95% ДИ 8…32) [7] (Рис. 3).
Рис. 3. Риск венозного тромбоза для генотипа MTHFR 677ТТ по сравнению с генотипом MTHFR 677CC. Квадраты чёрного цвета показывают оценки риска для конкретного исследования; размер квадрата отражает статистический вес исследования, который обратно пропорционален ширине 95% ДИ. Горизонтальные линии указывают на 95%-ые доверительные интервалы (ДИ), а ромб – на суммарную оценку риска с соответствующим 95% доверительным интервалом, полученную в результате проведения метаанализа.
При исследовании 395 пациентов и 848 контролей было установлено, что вариант «T» является фактором риска врожденных дефектов нервной трубки [10]. Наличие генотип 677TT 1996). В мета-анализе 13 исследований эффектов полиморфизма MTHFR C677T (n=5001) вариант MTHFR T был связан со значительно повышенным риском развития врожденные пороки сердца (ОШ 1.16, 95% ДИ 0.99-1.36, р<0,001) [11]. Мета-анализ 20 исследований, включивший 2101 матерей, родивших ребенка с синдромом Дауна и 2702 матерей из группы контроля показал, что гомозиготный вариант MTHFR 677TT у матери соответствует увеличению риска синдрома у ребенка на 50% (ОШ 1.51, 95% ДИ 1.22-1.87) [12]. Таким образом, дотации рибофлавина будут противодействовать всем этим эффектам генотипа MTHFR 677TT, профилактируя фолат-резистентные ВПР. Поэтому, не только дотации фолиевой кислоты, но и рибофлавина принципиально важны для осуществления биологических эффектов фолатов.
Об эпидемиологии и доказательной медицине рибофлавинаНедостаточность витамина В2 часто обнаруживается у женщин с повышенным риском преэклампсии (33,8% обследованных, n=154). Недостаточность витамина В2 нарастала к концу беременности (27,3% на 29-36-ой неделе беременности и 53,3% после 36-ой недели). В группе с недостаточностью витамина В2 преэклампсия встречалась весьма часто (28,8%) по сравнению с группой беременных, обеспеченных рибофлавином (7,8%, ОШ 4,7, 95% ДИ 1,8...12,2, Р<0.001). Недостаточная концентрация кофакторов ФАД/ФМН способствует формированию митохондриальной дисфункции, усилению окислительного стресса, нарушениям синтеза оксида азота NO. Таким образом, недостаточность витамина В2 следует рассматривать как возможный фактор риска преэклампсии [12].
Недостаточное потребление витаминов А, С, фолатов и рибофлавин ассоциировано с повышенным риском развития дисплазии шейки матки. Повышенный риск дисплазии установлен для двух нижних квартилей диетарного потребления витамина В2 (Р=0.04) [13].
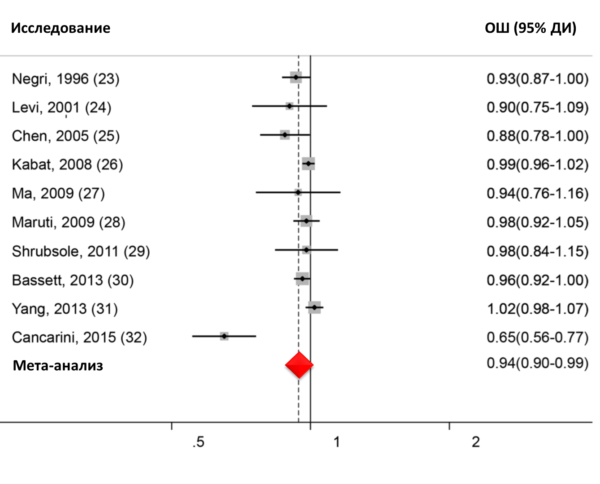
Данные доказательной медицины указывают на перспективность использования рибофлавина для профилактики/терапии мигрени, анемии, гипергликемии, сахарного диабета, гипертонии, нейропатологии и депрессивных расстройств, опухолевых заболеваний и др. [14]. В частности, мета-анализ 10 исследований пациенток с опухолями молочной железы (n=12268) подтвердил, что наибольшее потребление витамина B2 по сравнению с самым низким потреблением соответствует 15%-ному снижению риска развития опухолей (ОР 0,85, 95% ДИ 0,76...0,95). Анализ дозозависимых эффектов показал, что приращение суточного потребления витамина В2 на каждый 1 мг/сут было ассоцировано с 6% -ным снижением риска (ОР 0,94, 95% ДИ 0,90...0,99, Рис. 4.) [15].
Рис. 4. Оценки риска опухолей молочной железы, связанные с диетарным потреблением каждого 1 мг/сут витамина В2.Анализ данных по новорожденным с поперечными дефектами конечностей (n=324) или с продольными дефектами конечностей (n=158) и по новорожденным без ВПР (n=4982) показал, что риск продольных дефектов был выше для самых низких квартилей потребления фолатов (в 3,86 раза, 95% ДИ 1,08…13,78), витамина B6 (в 4,36 раза, 95% ДИ 0,93…20,48) и рибофлавина (в 2,94 раза, 95% ДИ 1,04-8,32). Риск поперечных дефектов конечностей также повышался для самого низкого квартиля потребления рибофлавина (в 1,54 раза, 95% ДИ: 1,00-2,37) [16].
Риск расщелин нёба и губы у новорожденных (n=704) был ниже при более высоком потреблении ВМК, содержащих фолаты (ОШ 0,88, 95% ДИ 0,73...1,07), холин, метионин, железо и рибофлавин (>2,47 мг/сут: ОШ 0,47, 95% ДИ 0,24...0,92) [17].
Исследование матерей, родивших ребенка с врожденными пороками сердца (дефекты оттока, n=190) и матерей, родивши ребёнка без ВПР (n=324) показало, что потребление витамина В2 было ниже у матерей, родивших ребенка с ВПР (1,32 мг/сут), чем в контроле (1,41 мг/сут, Р<0.05). Низкое диетарное потребление как рибофлавина (<1,20 мг/сут), так и никотинамида (<13,5 мг/сут) увеличивало риск ВПР более чем в 2 раза, особенно у матерей, которые не использовали дотации витаминов в периконцепцию (ОШ 2,4, 95% ДИ 1.4…4.0) [18].
Риск депрессии в срок от 2 до 9 месяцев после родов (n=121) был ниже на фоне более высокого диетарного потребления рибофлавина (ОШ 0,53, 95% ДИ 0,29...0,95) [19].
О синергизме между рибофлавином и магниемВ клинической практике врач часто сталкивается с проблемой сочетанной недостаточности и рибофлавина, и магния. Распространенность сочетанной недостаточности и магния и рибофлавина показана в ряде клинико-эпидемиологических исследований, проведенных в различных регионах мира. Например, крупномасштабное исследование взрослых женщин в 9 провинциях Китая, проведенное в 2000-2011 годах, показало, что рибофлавином были обеспечены только 7% участниц, а магнием – 23% [20]. Не менее проблемная ситуация наблюдается и в странах Евросоюза: например, во французской выборке населения (n=2373, 10-92 лет) недостаточность потребления магния высока среди мужчин (72%) и женщин (83%) и сопровождалась дефицитами фолатов, железа, витамина С и рибофлавина [21]. Поэтому, для компенсации дефицитов и магния, и рибофлавина целесообразно использовать комбинированные препараты типа «магний + витамин В2».
По данным крупномасштабного российско-европейского исследования (n=2141), в западной Европе рибофлавином обеспечены только 45.4% женщин 20-45 лет, а в России – только 34.1%. Магнием были обеспечены 29.5% обследованных в Западной Европе, а в России – только 16.3% [22]. По данным скринингового обследования пациентов многопрофильных стационаров (n=2433), 50% обследованных характеризовались наличием недостаточности магния (Mg(ПК)<0.80 ммоль/л) [23]. У каждого пациента было исследовано наличие или отсутствие 142 диагнозов по МКБ-10. Анализ данных скрининга показал, что значения уровней магния Mg(ПК)<0.80 ммоль/л соответствуют статистически значимому повышению риска многочисленных патологий [24]. В группе здоровых добровольцев (ни одного диагноза по МКБ-10: пациенты, проходившие диспансеризацию) средние уровни магния в плазме крови составили 0.92±0.07 ммоль/л (95% Д.И. 0.82-0.96) [25].
Недостаточность магния оказывает негативное влияние на различные аспекты беременности [3]. У беременной повышается риск невынашивания и тромбофилии беременных [26], преэклампсии и эклампсии, гипертонии беременных, аритмии беременных [27], гестационного диабета, судорог икроножных мышц; усиливается тонус матки. При недостаточности магния беременные жалуются на боли в спине и пояснице, а также боли и чувство тяжести в области костно-мышечного апоневроза в тазовом отделе. Участие магния в регуляции плацентарных белков [28], метаболизме сахаров, поддержке соединительной ткани [29] и нейропротекции мозга плода [30] делает дотации магния важным средством профилактики врождённых пороков развития, ДЦП [31] и избыточной массы тела новорожденных [32].
Повсеместно используемая в акушерстве процедура внутривенного вливания магния является эффективной скоровспомощной процедурой, позволяющей преодолеть гиомагнеземию в максимально короткие сроки (минуты-часы). Однако, долговременного эффекта такие процедуры не дают. Для профилактики хронической недостаточности магния необходимо использовать per os препараты на основе органических солей магния, отличающиеся высокой биодоступностью и безопасностью [33].
Пероральные препараты на основе органических солей магния (цитрат магния и др.) эффективны, в частности, для устранения судорог икроножных мышц у беременных. Судороги икроножных мышц и аритмия являются «быстрыми» последствиями недостаточности магния и представляют собой самую распространенную жалобу во второй половине беременности (45% случаев) [34]. В целом, судороги обременительны для беременной, так как ухудшают сон и самочувствие. Мета-анализ 5 исследований беременных с судорогами икроножных мышц (n= 352) показал, что приём органических солей магния (цитрат, лактат) в течение 3 недель с высокой достоверностью уменьшал или полностью купировал судороги икроножных мышц (p=0,0002) без каких-либо побочных эффектов [35].
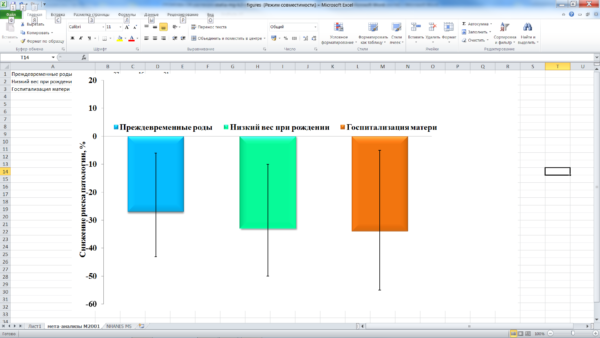
Дотации магния в виде органических солей позволяют осуществлять эффективную профилактику и более долговременных последствий недостаточности магния. Метаанализ 7 исследований беременных (n=2689) подтвердил позитивное влияние дотаций органических солей магния, назначаемых per os, на исход беременности и состояние беременной и плода. По сравнению с плацебо, приём магния до 25–ой недели беременности снижал частоту преждевременных родов (ОР 0,73; 95% ДИ 0,57–0,94, Рис. 5.) и рождение детей с низкой массой тела (ОР 0,67; 95% ДИ 0,46–0,96). Более того, женщины, принимавшие органический магний внутрь, были реже госпитализированы (ОР 0,66; 95% ДИ 0,49–0,89) и у них реже наблюдались явления угрозы прерывания беременности (ОР 0,38; 95% ДИ 0,16–0,90, Рис. 6.) [36].
Рис. 5. Снижение риска преждевременных родов в мета-анализе [36]. Здесь и далее горизонтальная линия отображает 95% достоверный интервал (95% Д.И.), положение центрального квадрата – отношение шансов (О.Ш.), а размер квадрата показывает местонахождение 25%-75% значений. Наблюдаемые эффекты тем сильнее, чем дальше от центральной линии расположены О.Ш. и 95% Д.И.
Рис. 6. Снижение риска преждевременных родов, низкого веса при рождении и госпитализации матери при приеме органических солей магния per os во время беременности (по результатам мета-анализа [36]). Показаны значение снижения относительного риска каждой патологии и 95% достоверные интервалы.
О коррекции недостаточности витамина В2 и магния посредством водных растворовКак было отмечено выше, органические соли магния характеризуются высокой биодоступностью (до 50%), в отличие от устаревших неорганических форм (оксид магния, сульфат магния и др), биодоступность которых не превышает 5% [3]. Поэтому, практического эффекта, а именно, компенсации недостаточности магния, от неорганических форм ожидать не приходится. Более того, неорганические формы магния способствуют развитию диареи. Соответственно, необходимо использовать высокоусвояемые и нетоксические соли магния (прежде всего, цитрат магния).
Цитрат магния - наиболее растворимая соль магния, характеризующая наивысшей биодоступностью. В организме цитрат-анион практически полностью превращается в углекислый газ и воду в цикле Кребса; практически полная утилизация цитрата делает его «экологически чистой тарой» для транспорта магния внутрь клеток посредством специальных цитратных каналов-транспортёров. Поэтому, цитрат магния является одной из самой эффективных солей для компенсации гипомагнеземии [3].
Практическое применение даже такой весьма «передовой» формы магния как цитрат магния имеет определенные особенности. Прежде всего, следует принимать во внимание, что реакции образования кристаллогидратов из безводных солей (и, в частности, безводного цитрата магния) являются, как правило, экзотермическими [37], то есть происходят с выделением тепла. Экзотермический эффект связан с тем, что при разрушении кристаллической решетки под воздействием молекул воды электростатическая энергия стабилизация решетки рассеивается и переходит в тепловую энергию.
Очевидно, что «разогрев» таблетки, спрессованной из безводного цитрата магния, может приводить к нежелательным органолептическим последствиям. Во-первых, ощущение «разогрева таблетки» во рту, при попадании слюны на безводный цитрат магния, довольно неприятное ощущение. Во-вторых, попадание таблетки из безводного цитрата магния внутрь ЖКТ может приводить к ожогам пищевода и желудка или, по крайней мере, к ощущению тошноты (которое связано вовсе не с самим цитратом магния, а именно с выделением тепла при растворении безводного цитрата магния). В-третьих, даже если запить таблетку из безводного цитрата магния значительным количеством воды, это существенно не снизит тепловыделение которое будет происходить именно в организме пациента.
Помимо использования органических форм магния и других микронутриентов, всё большее распространение приобретают растворы для питья, приготовляемые непосредственно перед употреблением. Обычно для компенсации дефицитов магния и витаминов группы В используются твёрдые лекарственные формы (прежде всего, таблетки), содержащие множество вспомогательных компонентов, небезопасных для здоровья (диоксид титана, алюмосодержащие вещества и др.), негативно влияющие на транскриптом и протеом. Например, диоксид титана способствует повышению провоспалительных цитокинов IL-1b, IL-4, IL-5, IL-6, G-CSF, CCL-2, CCL-3, CCL-4 [38]. Кроме того, усвоение микронутриентов из твёрдых форм в существенной мере зависит от растворимости формы, интенсивности и консистенции кишечного транзита, секреции желчных кислот и многих других факторов.
Учитывая описанный выше экзотермический эффект при растворении цитрата магния и, также, другие недостатки твёрдых фармацевтических форм микронутриентов, вполне понятно, что более эффективна компенсация микронутриентов из водных растворов. Для этого идеально подходят такие формы цитрата магния, которые приготовляется непосредственно перед употреблением, в форме раствора для питья. Для этого вполне подходят саше для приготовления питьевого раствора цитрата магния («Магний диаспорал 300», 1830 мг магния цитрата, 295.7 мг элементного магния, рибофлавина – 1.5 мг). Очевидно, что в данном случае реакция образования раствора цитрата магния происходит вне организма и пациент употребляет уже готовый раствор цитрата магния, без «отягощений», связанных с выделением тепла.
ЗаключениеПерсонализированный подход к коррекции микронутриентов должен учитывать хотя бы ключевые особенности клинического портрета пациента. Например, пациенткам, страдающим перепадами настроения, предменструальным синдромом сопровождающимся резкими перепадами настроения, женщинам с психическими заболеваниями (пограничными нервнопсихическими расстройствами, шизофренией, при алкогольном делирии, а также при истероидном типе поведения) можно рекомендовать использовать препараты, содержащие повышенные дозы пиридоксина и органические соли магния (глицинат магния, пироглутамат магния, цитрат магния). В то же время, беременным с высокой физической нагрузкой (спортсменки, работа стоя на ногах, работа в условиях холодового стресса и др.), женщинам с астенией, судорогами мышц (вследствие энергетического дефицита в работе митохондрий в условиях холодового воздействия или избыточной физической нагрузке), женщинам страдающим гипергомоцистеинемией, гипоглутатионемией, имеющим генотип MTHFR 677TT, а также пациенткам с головной болью и установленным диагнозом мигрень целесообразно рекомендовать комбинацию именно рибофлавина и цитрата магния. Использование других органических форм магния – глюконат магния, глицинат магния, лактат магния и аспарагинат магния существенно уступают цитрату магния в решении проблем холодового стресса, стресса при перетренировке мышц, а также в лечении мигрени, т.к. кроме магния эффективен сам лиганд – цитрат анион. Использование водных растворов цитрата магния и рибофлавина (т.н. «концепция лечебной минеральной воды с заданными свойствами») позволяет не только увеличить всасывание действующих начал. Водные растворы безопасны для беременных, так как позволяют полностью исключить поступление балластных веществ (диоксид титана, ароматизаторы, сахароза, тальк, воск, алюмосодержащий каолин и др.), которые могут наносить вред организму, особенно при длительном применении.
Литература1. Li Y, Zhang Q, Qi D, Zhang L, Yi L, Li Q, Zhang Z. Valproate ameliorates nitroglycerin-induced migraine in trigeminal nucleus caudalis in rats through inhibition of NF-кB. J Headache Pain. 2016;17:49. doi: 10.1186/s10194-016-0631-z. PMID: 27150105;
2. McNulty H, Pentieva K, Hoey L, Ward M. Homocysteine, B-vitamins and CVD. Proc Nutr Soc. 2008 May;67(2):232-7. doi: 10.1017/S0029665108007076.
3. Громова О.А., Торшин И.Ю. Магний и «болезни цивилизации». Москва : ГЭОТАР-Медиа, 2018. — 800 с. : ил. ; 25 см. — 3000 экз. — ISBN 978-5-9704-4527-3.
4. Masui T, Staple E. The formation of bile acids from cholesterol. The conversion of 5-beta-cholestane-3-alpha,7-alpha-triol-26-oic acid to cholic acid via 5-beta-cholestane-3-alpha,7-alpha,12-alpha, 24-xi-tetraol-26-oic acid I by rat liver. J Biol Chem. 1966 Sep 10;241(17):3889-93. PubMed PMID: 5920800.
5. Hoey L, McNulty H, Strain JJ. Studies of biomarker responses to intervention with riboflavin: a systematic review.Am J Clin Nutr. 2009 Jun;89(6):1960S-1980S. doi: 10.3945/ajcn.2009.27230B. Epub 2009 Apr 29. PubMed ID:19403631
6. Громова О.А., Ребров В.Г. «Витамины, макро- и микроэлементы. Обучающие программы РСЦ института микроэлементов ЮНЕСКО» ISBN: 978-5-9704-0814-8. Издательство: Гэотар-Медиа Год издания: 2008. 954 C.
7. Den Heijer M, Lewington S, Clarke R. Homocysteine, MTHFR and risk of venous thrombosis: a meta-analysis of published epidemiological studies.J Thromb Haemost. 2005 Feb;3(2):292-9. doi: 10.1111/j.1538-7836.2005.01141.x. PubMed ID:15670035
8. Torshin I.Yu (Ed. Gromova OA). Sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books, NY, USA, 2009, In “Bioinformatics in the Post-Genomic Era” series, ISBN 1-60692-217-0.
9. McNulty H, Dowey LC, Strain JJ, Dunne A, Ward M, Molloy AM, McAnena LB, Hughes JP, Hannon-Fletcher M & Scott JM (2006). Riboflavin lowers homocysteine in individuals homozygous for the MTHFR 677C/T polymorphism. Circulation 113, 74–80.
10. Kirke PN, Mills JL, Molloy AM, Brody LC, O'Leary VB, Daly L, Murray S, Conley M, Mayne PD, Smith O, Scott JM.Impact of the MTHFR C677T polymorphism on risk of neural tube defects: case-control study. BMJ. 2004 Jun 26;328(7455):1535-6.11. Nie Y1, Gu H, Gong J, Wang J, Gong D, Cong X, Chen X, Hu S. Methylenetetrahydrofolate reductase C677T polymorphism and congenital heart disease: a meta-analysis. Clin Chem Lab Med. 2011 Dec;49(12):2101-8. doi: 10.1515/CCLM.2011.673. Epub 2011 Jul 28.
12. Wacker J, Fruhauf J, Schulz M, Chiwora FM, Volz J, Becker K. Riboflavin deficiency and preeclampsia.Obstet Gynecol. 2000 Jul;96(1):38-44. PubMed ID:10862839
12. Costa-Lima MA1, Amorim MR, Orioli IM. Association of methylenetetrahydrofolate reductase gene 677C > T polymorphism and Down syndrome. Mol Biol Rep. 2013 Mar;40(3):2115-25. doi: 10.1007/s11033-012-2270-z. Epub 2012 Nov 25.
13. Liu T, Soong SJ, Wilson NP, Craig CB, Cole P, Macaluso M, Butterworth CE Jr. A case control study of nutritional factors and cervical dysplasia.Cancer Epidemiol Biomarkers Prev. 1993 Nov-Dec;2(6):525-30. PubMed ID:8268768
14. Thakur K, Tomar SK, Singh AK, Mandal S, Arora S. Riboflavin and health: A review of recent human research. Crit Rev Food Sci Nutr. 2017 Nov 22;57(17):3650-3660. doi: 10.1080/10408398.2016.1145104. Review. PubMed PMID:27029320.
15. Yu L, Tan Y, Zhu L. Dietary vitamin B2 intake and breast cancer risk: a systematic review and meta-analysis.Arch Gynecol Obstet. 2017 Mar;295(3):721-729. doi: 10.1007/s00404-016-4278-4. Epub 2016 Dec 29. PubMed ID:28035488
16. Robitaille J, Carmichael SL, Shaw GM, Olney RS. Maternal nutrient intake and risks for transverse and longitudinal limb deficiencies: data from the National Birth Defects Prevention Study, 1997-2003.Birth Defects Res A Clin Mol Teratol. 2009 Sep;85(9):773-9. doi: 10.1002/bdra.20587. PubMed ID:19350655
17. Shaw GM, Carmichael SL, Laurent C, Rasmussen SA. Maternal nutrient intakes and risk of orofacial clefts.Epidemiology. 2006 May;17(3):285-91. doi: 10.1097/01.ede.0000208348.30012.35. PubMed ID:16570024
18. Smedts HP, Rakhshandehroo M, Verkleij-Hagoort AC, de Vries JH, Ottenkamp J, Steegers EA, Steegers-Theunissen RP. Maternal intake of fat, riboflavin and nicotinamide and the risk of having offspring with congenital heart defects.Eur J Nutr. 2008 Oct;47(7):357-65. doi: 10.1007/s00394-008-0735-6. Epub 2008 Sep 8. PubMed ID:18779918
19. Miyake Y, Sasaki S, Tanaka K, Yokoyama T, Ohya Y, Fukushima W, Saito K, Ohfuji S, Kiyohara C, Hirota Y. Dietary folate and vitamins B12, B6, and B2 intake and the risk of postpartum depression in Japan: the Osaka Maternal and Child Health Study.J Affect Disord. 2006 Nov;96(1-2):133-8. doi: 10.1016/j.jad.2006.05.024. Epub 2006 Jul 11. PubMed ID:16815556
20. Du W, Wang H, Chen S, Su C, Zhang H, Zhang B. [Trend of dietary nutrient intake among adult females in 9 provinces in China, 2000-2011]. Zhonghua Liu Xing Bing Xue Za Zhi. 2015;36(7):715-719.
21. Touvier M, Lioret S, Vanrullen I, Bocle JC, Boutron-Ruault MC, Berta JL, Volatier JL. Vitamin and mineral inadequacy in the French population: estimation and application for the optimization of food fortification. Int J Vitam Nutr Res. 2006;76(6):343-351.
22. Лиманова О.А., Торшин И.Ю., Сардарян И.С., Калачева А.Г., Hababpashev A., Karpuchin D., Kudrin A., Юдина Н.В., Егорова Е.Ю., Белинская А.Ю., Гришина Т.Р., Громов А.Н., Федотова Л.Э., Рудаков К.В., Громова О.А. Обеспеченность микронутриентами и женское здоровье: интеллектуальный анализ клинико-эпидемиологических данных. Вопросы гинекологии, акушерства и перинатологии. 2014. Т. 13. № 2. С. 5-15. 23. Громова О.А., Калачева А.Г., Торшин И.Ю., Гришина Т.Р., Семенов В.А. Диагностика дефицита магния. концентрации магния в биосубстратах в норме и при различной патологии. Кардиология. 2014. Т. 54. № 10. С. 63-71. 24. Громова О.А., Лиманова О.А., Гоголева И.В., Гришина Т.Р., Громов А.Н., Егорова Е.Ю., Калачева А.Г., Прозорова Н.В., Торшин И.Ю., Сардарян И.С., Семенов В.А., Юдина Н.В. Анализ взаимосвязи между обеспеченностью магнием и риском соматических заболеваний у россиянок 18-45 лет методами интеллектуального анализа данных. Эффективная фармакотерапия. 2014. № 23. С. 10-23. 25. Громова О.А., Калачева А.Г., Торшин И.Ю., Рудаков К.В., Грустливая У.Е., Юдина Н.В., Егорова Е.Ю., Лиманова О.А., Федотова Л.Э., Грачева О.Н., Никифорова Н.В., Сатарина Т.Е., Гоголева И.В., Гришина Т.Р., Курамшина Д.Б., Новикова Л.Б., Лисицына Е.Ю., Керимкулова Н.В., Владимирова И.С., Чекмарева М.Н. с соавт. Недостаточность магния — достоверный фактор риска коморбидных состояний: результаты крупномасштабного скрининга магниевого статуса в регионах России. Фарматека. 2013. № 6 (259). С. 116-129. 26. Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Рудаков К.В. Магний и тромбофилия беременных: молекулярные механизмы и доказательная медицина. Российский вестник акушера-гинеколога. 2009. Т. 9. № 6. С. 75-80. 27. Громова О.А., Калачева А.Г., Торшин И.Ю., Гришина Т.Р., Юдина Н.В. Калийсберегающие свойства магния. Кардиология. 2013. Т. 53. № 10. С. 38-48. 28. Торшин И.Ю., Громова О.А., Сухих Г.Т., Рудаков К.В. Молекулярные механизмы регуляции магнием плацентарных белков. Российский вестник акушера-гинеколога. 2008. Т. 8. № 6. С. 9-16. 29. Громова О.А., Торшин И.Ю., Егорова Е.Ю. Механизмы воздействия магния и пиридоксина на структуру и свойства соединительной ткани как основание для магнезиальной терапии дисплазий соединительной ткани. Лечащий врач. 2010. № 8. С. 71. 30. Громова О.А., Торшин И.Ю., Калачева А.Г., Курамшина Д.Б. Молекулярно-биологические основы нейропротекторных эффектов магния. Журнал неврологии и психиатрии им. C.C. Корсакова. 2011. Т. 111. № 12. С. 90-101. 31. Громова О.А., Лисицына Е.Ю., Торшин И.Ю., Грачева О.Н. Магниевые тайны библиотеки кохрана: современный взгляд на проблему. Российский вестник акушера-гинеколога. 2011. Т. 11. № 5. С. 20-27. 32. Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Сидельникова В.М. Нутрициальный подход к профилактике избыточной массы тела новорожденных. Гинекология. 2010. Т. 12. № 5. С. 56-64. 33. Громова О.А., Торшин И.Ю., Юргель И.С. Ретроспектива фармакокинетических исследований магниевых препаратов. Трудный пациент. 2009. Т. 7. № 6-7. С. 42-46.34. Young GL, Jewell D. Interventions for leg cramps in pregnancy. Cochrane atabase of Systematic Reviews 2002, Issue 1. Art. No.: CD000121. DOI: 10.1002/14651858. CD000121.
35. Dahle L.O., Berg G, Hammar M, Hurtig M, Larsson L. The effect of oral magnesium substitution on pregnancy-induced leg cramps. Am J Obstet Gynecol. 1996 Jul;175(1):233-4.
36. Makrides M, Crowther CA.Magnesium supplementation in pregnancy.Cochrane Database Syst Rev. 2001;(4):CD000937.
37. Азиева Л.М., Архангельская О.В., Батаева Е.В., Гришина Т.М., Гузей Л.С., Жмурко Г.П., Загорский В.В., Кузнецов В.Н., Лебедева О.К., Серопегин Ю. Д., Татаркина А.Л., Штепа В.И. Практическое пособие по общей неорганической химии (под редакцией д.х.н., профессора С.Ф. Дунаева). Химический факультет МГУ, Москва, 2002.38. Halappanavar S, Saber AT, Decan N, Jensen KA, Wu D, Jacobsen NR, Guo C, Rogowski J, Koponen IK, Levin M, Madsen AM, Atluri R, Snitka V, Birkedal RK, Rickerby D, Williams A, Wallin H, Yauk CL, Vogel U. Transcriptional profiling identifies physicochemical properties of nanomaterials that are determinants of the in vivo pulmonary response. Environ Mol Mutagen. 2015 Mar;56(2):245-64. doi: 10.1002/em.21936.
Сведения об авторах:
Сведения об авторах:
Громова Ольга Алексеевна – д-р мед. наук, проф., в.н.с., научный руководитель Института Фармакоинформатики, ФИЦ «Информатика и Управление» РАН, Адрес: 119333, Москва, ул. Вавилова, 42, Телефон: +7(916) 108-09-03 e-mail: unesco.gromova@gmail.com, сайт: pharmacoinformatics.ru
РИНЦ SPIN-код: 6317-9833, AuthorID: 94901, Scopus Author ID: 7003589812, ORCID iD https://orcid.org/0000-0002-7663-710X, WOS ID J-4946-2017
Торшин Иван Юрьевич, к.х.н., с.н.с. Институт Фармакоинформатики, ФИЦ «Информатика и Управление» РАН, Адрес: 119333, Москва, ул. Вавилова, 42, Телефон: (499) 135-2489 Scopus Author ID: 7003300274, РИНЦ SPIN-код: 1375-1114, AuthorID: 54104, ORCID iD 0000-0002-2659-7998, WOS ID C-7683-2018
Тетруашвили Нана Картлосовна, д.м.н., профессор, зав. 2-м отделением акушерским патологии беременности ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-11-83. E-mail: n_tetruashvili@oparina4.ru
Рейер Иван Александрович, к.м.н, с.н.с. Институт Фармакоинформатики, ФИЦ «Информатика и Управление» РАН, Адрес: 119333, Москва, ул. Вавилова, 42, Телефон: (499) 135-2489
About the authors:
Gromova Olga Alekseevna., Professor, Doctor of Medical Sciences, Science Нead of the Institute of Pharmacoinformatics, leading researcher of the Department of Intellectual Systems FRCCSC RAS, Federal Research Center “Computer Science and Control” of Russian Academy of Sciences, 119333, Russian Federation, 119333, Moscow, Vavilova, 42, Phone: +7(499) 783-3327 unesco.gromova@gmail.com
Torshin Ivan Yurevich., PhD in Applied Mathematics, PhD in Chemistry, Senior researcher in Laboratory of Pharmacoinformatics at the Department of Intellectual Systems FRCCSC RAS, Federal Research Center “Computer Science and Control” of Russian Academy of Sciences, 119333, Russian Federation, 119333, Moscow, Vavilova, 42, Phone: +7(499) 783-3327, tiy135@ccas.ru
Scopus Author ID: 700330027, РИНЦ SPIN-код: 1375-1114
AuthorID: 54104, ORCID iD 0000-0002-2659-7998, WOS ID C-7683-2018
Tetruashvili Nana Kartlosovna, Doctor of Medicine, Head of the Department of Pregnancy Loss Prevention and Therapy, Research Center for Obstetrics, Gynecology and Perinatology, Ministry of Health of Russia. 117997, Russia, Moscow, Ac. Oparina str. 4. Tel.: +74954381183. E-mail: tetrauly@mail.ru
Reier Ivan Aleksandrovich, PhD, Senior researcher in Laboratory of Pharmacoinformatics at the Department of Intellectual Systems FRCCSC RAS, Federal Research Center “Computer Science and Control” of Russian Academy of Sciences, 42, Vavilova, Moscow, 1119333, Russian Federation, 119333, Russian Federation, 119333, Moscow, Vavilova, 42, Phone: +7(499) 783-3327